
近日,塞力醫療集團(股票代碼:603716.SH)參股公司北京康達行健科技發展有限公司(以下簡稱“康達行健”)傳來捷報。康達行健成為全國首家獲批“人體干細胞技術開發和應用、人體基因診斷與治療技術開發”執照的中外合資企業!這一歷史性突破標志著中國醫療領域開放試點的政策在北京亦莊新城率先取得實質性進展。
塞力醫療正以前所未有的力度,構建一個覆蓋細胞培養、細胞凍存、細胞藥物臨床應用、免疫細胞療法臨床研究等全維度的產業體系。在公司戰略資源整合及臨床孵化下,集團通過與國央企合作共同建立全球領先的細胞存儲質量檢測標準,推動自體免疫細胞存儲質量的第三方檢測(推動行業標準和國家標準制定)、針對于抗衰和治療的免疫細胞存儲、培養等業務以提升企業價值,全面構筑細胞治療方案的核心競爭壁壘。

勇立潮頭者先得世界。9月8日,商務部、國家衛生健康委、國家藥監局三部門聯合發布《關于在醫療領域開展擴大開放試點工作的通知》,允許在特定區域內的外商投資企業從事人體干細胞、基因診斷與治療技術的開發和技術應用。這項政策如同一股強勁的東風,為外商投資企業在人體干細胞、基因診斷與治療技術等前沿領域的開發和技術應用開辟了新天地。康達行健敏銳地捕捉到了這一歷史性的機遇,迅速調整戰略,乘風起勢,在亦莊新城的全力支持和指導下,僅在一個月內就順利完成了營業執照變更和前期準備工作,成為全國首家獲批的外商投資的基因與細胞治療技術企業。




自1931年瑞士醫生保羅·尼漢斯首次成功應用細胞療法以來,該領域經歷了近一個世紀的發展與挑戰。如今,細胞療法已成為全球醫療研究的焦點,隨著技術的進步,細胞科技成果的爆發與應用進入“井噴期”。作為再生醫學的關鍵部分,細胞療法為解決復雜難治性疾病提供了新的希望,并引領著一場顛覆性的醫療革新。
近十年來,全球在研的細胞治療產品管線呈爆發式增長。據弗羅斯特沙利文數據,我國細胞治療市場空間將由2021年的13億元增長至2030年的584億元,年均增速高達53%。其中CAR-T細胞療法市場空間將由2021年的2-3億元增長至2030年的287億元;其他細胞治療市場空間將由2021年的10億元增長至2030年的297億元。
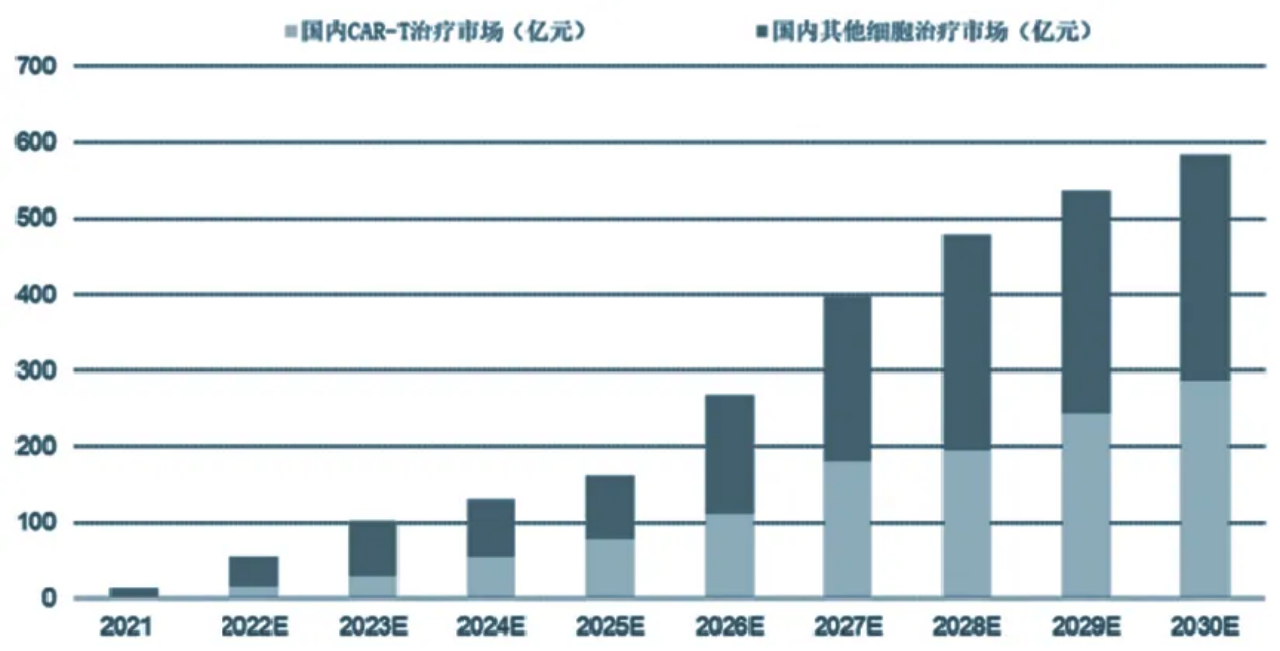
國內細胞療法市場空間
細胞與基因治療產能瓶頸迫切需要解決。 由于目前市場上能夠大規模生產質粒DNA和病毒載體的CDMO公司相對較少,限制了細胞與基因治療產能。大多數具備生產能力的CDMO公司都處于供不應求的狀態,導致生物制藥公司需要等待較長時間,據L.E.K.統計,細胞與基因治療CDMO平均等待時間約16個月,成為細胞與基因治療行業的痛點。另外保守估計,2021-2025年細胞與基因治療增長的管線和藥物上市會讓接受細胞與基因治療的患者數量增長20%-25%,產能瓶頸將進一步加劇。
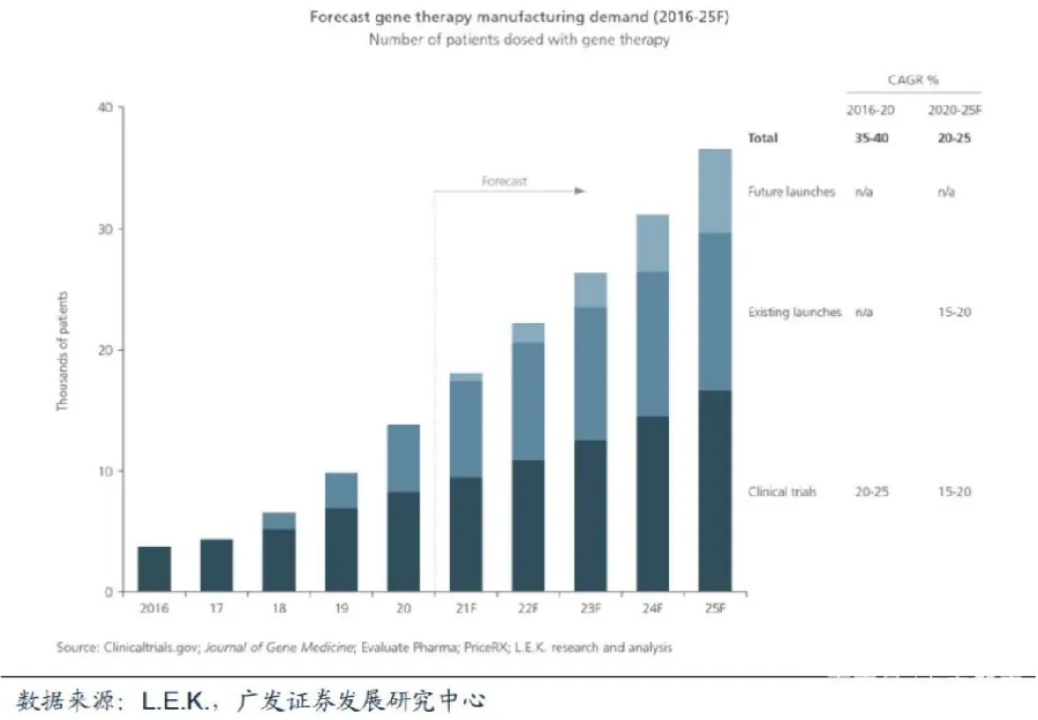
全球細胞與基因治療患者需求預測
同時,細胞基因療法市場前景廣闊,資本不斷涌入,大型藥企也通過收購、合作開發、自主研究等形式踏足基因療法,為細胞與基因治療的發展提供持續動力,據McKinsey披露,到2020年2月為止,全球Top 20藥企中已有16家布局細胞基因治療研發管線。
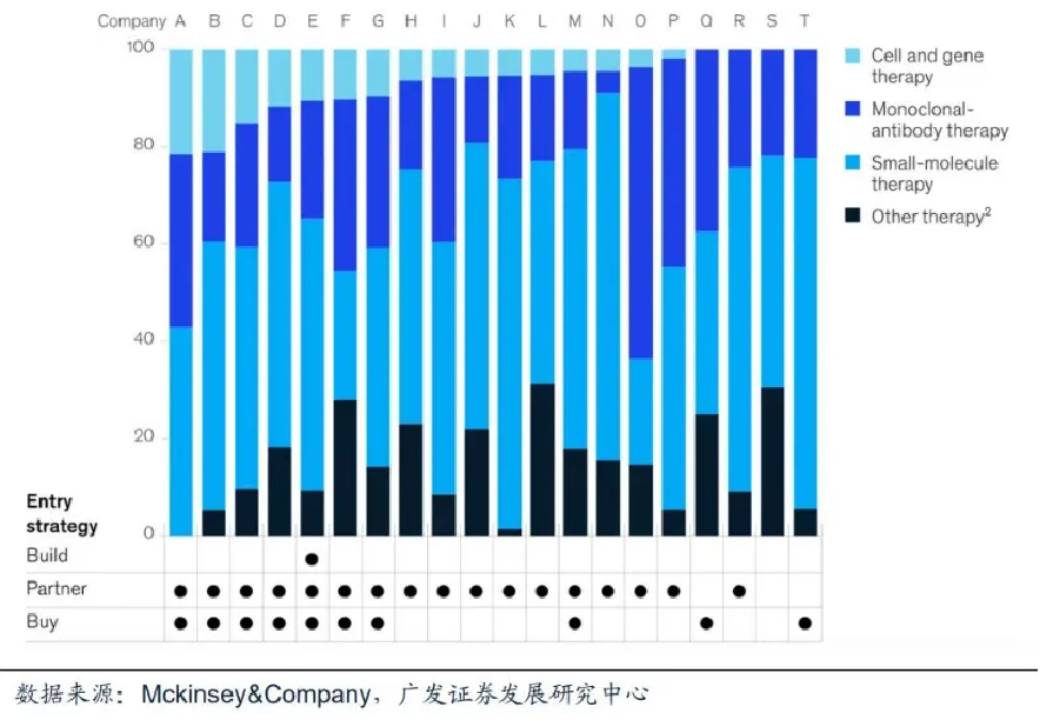
全球Top 20藥企細胞基因治療研發管線

作為獲得國際專利的試劑技術和細胞培養工藝技術,康達行健的活化自體淋巴細胞療法(關根法)來自日本逾30年的尖端技術和原班人馬,受監管認可且已證實臨床療效。
康達行健細胞療法技術來源于由關根暉彬博士帶隊,1987年在日本國立癌癥中心開發的新型細胞免疫治療技術“活化自體淋巴細胞療法”。近年美國國立衛生院(NIH)等臨床研究發現Tcm及克隆化T細胞的記憶性、持久性和擴增性使其具備高效抗腫瘤特性,國內外實際病例中對抗各類實體腫瘤和病毒的效果顯著。在日本該細胞療法已臨床治療超6萬例且證實安全有效。
康達行健自2015年成為全國首家從日本引進活化自體淋巴細胞療法的企業,并與中國人民解放軍總醫院第五醫學中心{編者注:解放軍總醫院第五醫學中心是由原解放軍第302醫院和軍事醫學研究院原附屬醫院(原解放軍307醫院)合并組建而成}深度合作,雙方歷時近五年的臨床研究成果顯示,入組的64例臨床研究的肝癌患者,在手術后僅接受“關根法”活化自體淋巴細胞過繼性免疫治療,復發率降低59.6%,無進展生存期明顯延長,治療無不良反應。(研究成果發布在《中國腫瘤生物治療雜志》,被證實具有統計學意義,即治療效果具有一定普遍性。)
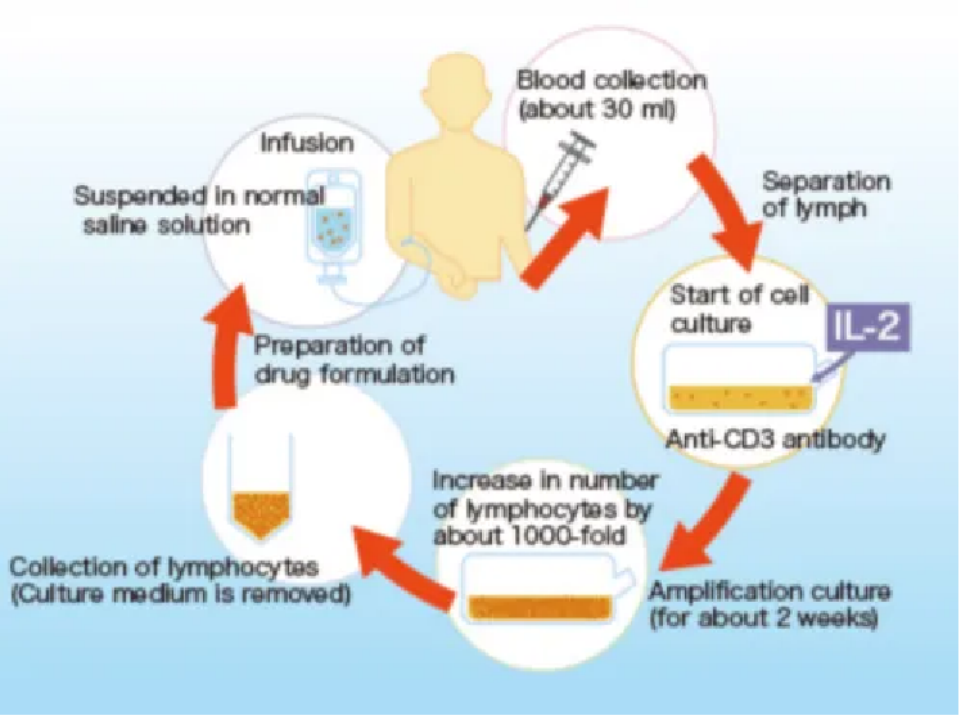
活化自體免疫細胞療法
其采用的細胞療法主要是通過提取患者自身淋巴細胞,結合自主研發培養技術,經凍存、活化、擴增等步驟后獲得以記憶性T細胞為主要成分(占比超過 70%-99%)的Tcm/Te 細胞用于治療患者。該細胞療法可作為手術、放化療的有效補充方法,達到防止術后復發、轉移為最終目的。

技術來源
日本國立癌癥中心、美國杜克大學 ,康達行健自主研發;
享譽全球的療法理念
活化自體淋巴細胞療法,是關根先生早年任職于日本國家癌癥中心時,研究和開發的淋巴細胞培養及以防止癌癥復發轉移為目的的免疫細胞療法;
領先的獨特技術
作為手術、放化療的有效補充方法,以防止術后復發、轉移為最終目的,倡導腫瘤多學科綜合治療的獨特技術;
極具臨床統計學意義和行業指導性
受到廣泛認可,至今作為公認的全世界免疫細胞治療最具臨床統計學意義的Lancet文獻之一,經常被行業內研究者所引用;
符合臨床使用的高質量要求療法理念
自制配套試劑,提高細胞制備的質與量。


前排右三:活化自體淋巴細胞治療創始人關根暉彬博士前排
左三:中國解放軍307醫院陳虎主任醫師前排
左二:北京康達行健董事長張鳳春女士
早在2015年,康達行健的母公司北京龍寶科技集團與日本“關根法”主研人關根博士以及中國解放軍307醫院的陳虎主任醫師簽署了三方合作協議,共同在我國首次推出“關根法”活化自體淋巴細胞治療方法,為癌癥患者帶來新的希望和福音。作為軍事醫學科學院細胞與基因治療中心主任,陳虎教授在307醫院開展了腫瘤細胞免疫療法的臨床試驗,并成功通過三個療程的細胞療法治療,使一位患有罕見惡性腫瘤——右腎血管周母細胞瘤的患者基本恢復了正常生活。這一成功案例為癌癥患者帶來新的曙光,免疫療法或將成為繼手術、放療、化療之后的一種新的腫瘤治療模式。

CCTV報道陳虎主任利用細胞療法治愈復發癌癥
2018年,解放軍總醫院牽頭,與包括中國醫學科學院腫瘤醫院、北京大學人民醫院、天津市腫瘤醫院、首都醫科大學附屬北京佑安醫院、北京大學腫瘤醫院和中國醫學科學院北京協和醫院等在內的國內多家頂尖醫院,開啟國內細胞治療領域大規模臨床招募,啟動免疫細胞治療用于防止肝癌根治術后復發的臨床試驗研究。
在此臨床試驗基礎上,2021年,解放軍總醫院第五醫學中心造血干細胞移植科主治醫師楊巖麗等及北京龍寶科技集團、北京康達行健張鳳春總裁、高島健一博士等撰寫臨床研究論文《活化自體淋巴細胞過繼性免疫治療在原發性肝細胞癌中的療效觀察》,在《中國腫瘤生物治療雜志》 (Chinese Journal of Cancer Biotherapy) 重磅發表。該研究項目是軍隊后勤科研重大項目資助課題,由解放軍總醫院第五醫學中心和北京龍寶科技集團及北京康達行健公司通力合作共同完成。


編者注*《活化自體淋巴細胞過繼性免疫治療在原發性肝細胞癌中的療效觀察》發表后引起了各大媒體的關注,《中國網》、《法制網》、《光明網》、《健康報》、《中國婦女網》、《搜狐網》、《新浪財經》、《東方財富》、《分析百科網》等十多家媒體都在顯著位置報道了這一科研成果。
查新表明,本項目所述的活化自體淋巴細胞免疫治療在原發性肝細胞癌術后預防,自體淋巴細胞采用的是記憶性T細胞(從血液中分離T 細胞后,加入 750 /ml 的重組工-2 和固定抗 CD3 單克降12抗體(5 g/ml)體外共培養,使記憶性T細胞擴增),培養好的記憶性 T 細胞每兩周給患者回輸1次細胞,每位患者共計回輸 6 次,每次回輸細胞數量平均是 10x109個。該臨床研究結果證明,活化自體免疫細胞治療為安全可行的肝癌輔助性治療方法,可提高Ⅰ-Ⅲ期肝癌術后無復發生存率,能延長患者無復發生存時間。
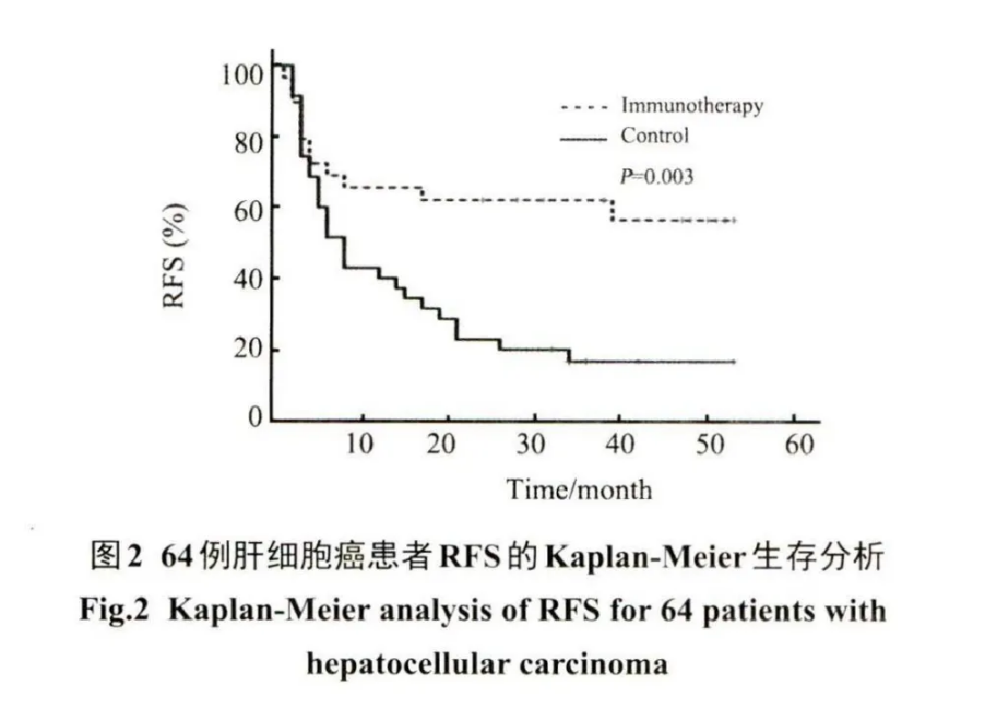
64例原發性肝細胞癌患者在分層隨機法分為免疫治療組(《=29)和對照組(n=35)后,免疫治療組29名患者共接受了167次( 計 劃 174次,完成率 96% )預定淋巴細胞輸注。與對照組相比,免疫治療組患者2年RFS率顯著升高(62.1% vs 22.9% ,0R=0.181,95% CI: 0.06~0.54,P=0.002),中位 PFS(28 vs 8個月,P=0.004)和中位OS(38 vs 34個月,P=0.915)均顯著延長。
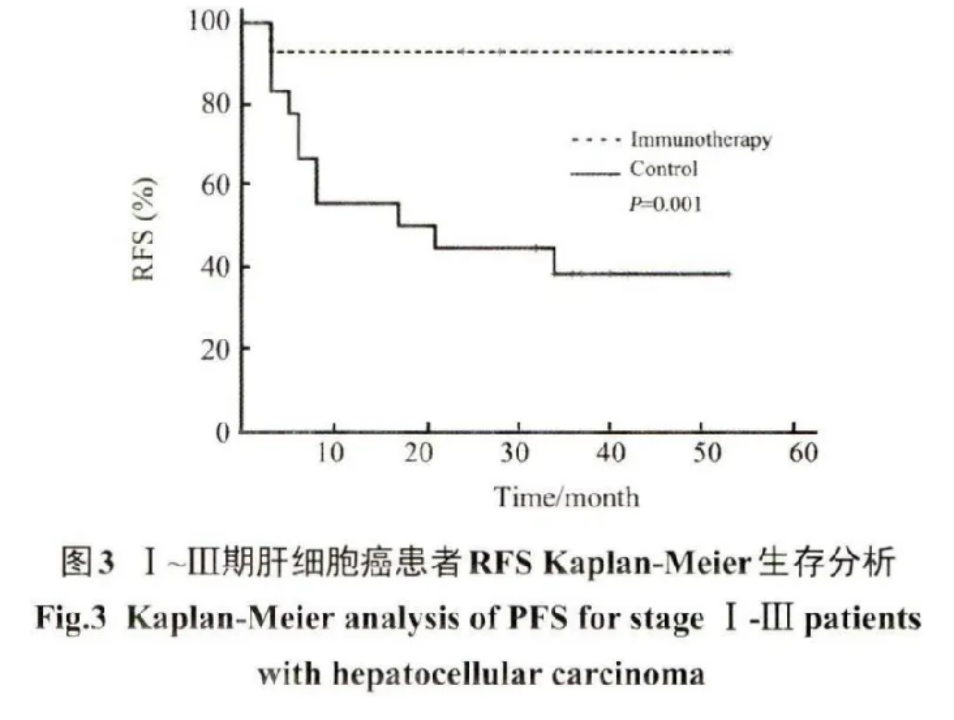
I ~III期 患 者 中 ,免 疫 治 療 組 僅 1例 復 發 ,而 對 照 組 有12 例 復 發 ,復 發 率 顯 著 降 低 (7.1 % vs 66.7% , OR=0.038, 95% CI: 0.004~0.368 , P=0.005 ) ; 免 疫 治 療 組 2 年 RFS較 對 照 組 顯 著 升 高 (92.9% vs 33.3%, P=0.005),中 位 PFS較 對 照 組 明 顯 延 長 (38.0 vs 14.5 個月 ,P=0.005)。
除了在癌癥治療領域的顯著成效外,活化自體免疫細胞療法也被證實對保健和抗衰老有積極作用。2023年,康達行健原研發總監施喆先生在接受采訪時提到,該公司的最高顧問關根博士自50多歲起便定期使用自己多年前在-196℃條件下保存的免疫細胞進行自體回輸。這種治療后,關根博士體內的DHEA-S含量明顯提升。(DHEA-S水平的下降被認為是人體衰老的一個重要標志)即便到了86歲高齡,關根博士仍然保持活躍的生活方式,包括每周攀巖、經常參與劃艇及高爾夫等運動。這是世界上較早被記錄下來的證明免疫細胞能夠長期保存并有效應用于抗衰老保健的成功例子之一。(信息來源:北京康達行健)

嗅覺敏銳是企業成功的關鍵。作為智慧新生態的先行者,塞力醫療早在2020年就瞄準了細胞治療的廣闊前景,并以全局產業鏈思維洞悉行業,積極部署,志在構建一個覆蓋細胞培養、凍存、檢測、臨床應用等產業閉環。
2020年12月,塞力醫療出資1500萬美元,認購了美國LevitasBio 27.48%的股權,并于次年5月與LevitasBio成立中美合資公司——力微拓生命科學,致力于將全球革新性的液相、磁懸浮無標記活細胞分離富集系統LeviCell?引入中國,服務國內臨床與科學研究。2024年力微拓與北京貝瑞基因的高通量測序技術深度結合,以高質量細胞樣本質量升級單細胞制備工作流程。

2021年5月,塞力醫療參股康達行健,旨在加速“活化自體淋巴細胞療法”在國內的臨床推廣,就癌癥患者(肝癌及膠質母細胞瘤)的“活化自體淋巴細胞療法”的預防術后復發效果進行共同研究。
如果說LeviCell?技術為細胞療法的細胞樣本質量(目標活細胞的純度)的檢測提供了及時、有力的保障,那對整份細胞質量的嚴格檢測則是直接關系到細胞治療的效果和患者安全。2024年3月集團獨立醫學檢驗實驗室——塞力醫檢(TML)與中檢檢驗認證集團(CCIC)深圳公司簽署細胞質量檢測行業標準及認證的框架協議,雙方致力推動細胞質量檢測行業的標準化和規范化發展,以期為細胞治療技術的廣泛應用和健康發展提供堅實保障。作為國家高新技術企業和上海市專精特新企業,TML還受邀參與了由中國出入境檢驗檢疫協會綜合質量服務標準化技術委員會(CIQA/TC12)、中檢檢驗認證集團(CCIC)深圳公司牽頭組織起草的《細胞因子誘導殺傷細胞檢驗規范》、《人牙髓干細胞檢驗規范 》等細胞質量檢測的團體標準,為細胞領域的檢測及治療技術創新及未來進入臨床應用保駕護航。

中檢深圳公司與塞力醫療旗下獨立醫學檢驗實驗室塞力醫檢簽署細胞治療檢測行業標準及認證框架協議
美國著名生物學家George Daley曾預言:“20世紀是藥物治療的時代,21世紀將是細胞治療的時代”。作為一種里程碑式的新型治療手段,高效活化自體淋巴細胞在伴隨技術和精準醫學的不斷成熟、政策體系逐步完善的推動下,未來無疑可期,前景必定廣闊!
風起,帆滿,奮楫正當時。面對細胞治療的廣闊藍海,塞力醫療將在“健康中國”戰略的指引下,始終以患者為中心,致力為國內癌癥患者點亮生命的希望之光!
免責聲明:市場有風險,選擇需謹慎!此文僅供參考,不作買賣依據。
關鍵詞:
版權與免責聲明:
1 本網注明“來源:×××”(非商業周刊網)的作品,均轉載自其它媒體,轉載目的在于傳遞更多信息,并不代表本網贊同其觀點和對其真實性負責,本網不承擔此類稿件侵權行為的連帶責任。
2 在本網的新聞頁面或BBS上進行跟帖或發表言論者,文責自負。
3 相關信息并未經過本網站證實,不對您構成任何投資建議,據此操作,風險自擔。
4 如涉及作品內容、版權等其它問題,請在30日內同本網聯系。